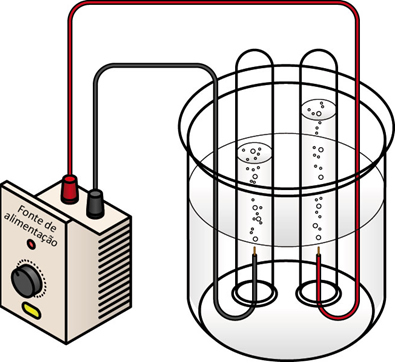
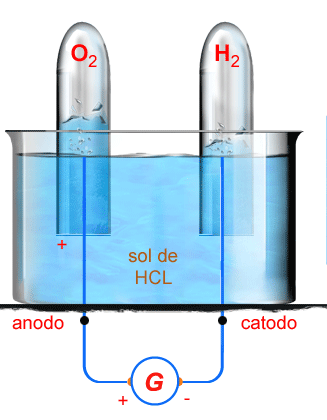
Processo
Por que o Brasil é campeão mundial em reciclagem de latas de alumínio?
1ª Tarefa:
Reuna-se com seus colegas de grupo em casa ou em uma Lan House, leia e debata com seu grupo os artigos presentes nos links abaixo, depois elabore uma síntese das conclusões a que vocês chegaram para ser apresentada para toda a turma e para o professor, na forma de uma apresentação de slides ou vídeo documentário.
História do alumínio
https://ciencia.hsw.uol.com.br/aluminio.htm
https://ciencia.hsw.uol.com.br/aluminio1.htm
https://www.rexamcan.com.br/produtos/latas.asp
Usos do alumínio no cotidiano
https://www.cempre.org.br/fichas_tecnicas.php?lnk=ft_latas_aluminio.php
https://www.melhoradm.com.br/latas%20embal%20vidros.htm
Ocorrência, obtenção industrial, propriedades e utilização
Propriedades químicas do alumínio
https://nautilus.fis.uc.pt/st2.5/scenes-p/elem/e01300.html
https://ciencia.hsw.uol.com.br/aluminio2.htm
Ciclo de vida do alumínio
https://www.hydro.com/pt/Subsites/Portalex/Produtos/Excelencia-na-extrusao/Ciclo-vida-do-aluminio/
Textos Complementares
https://pt.wikipedia.org/wiki/Alum%C3%ADnio
https://qnesc.sbq.org.br/online/qnesc13/13-aluminio.pdf

2ª Tarefa:
Leia e debata com seu grupo os artigos, vídeos e animações que estão na seção Recursos e em seguida proceda ao desenvolvimento das atividades abaixo:
A turma deverá elaborar um Folder sobre a Reciclagem do Alumínio, que será distribuído para a comunidade escolar, a fim de compartilhar com o maior número possível de pessoas a importância das informações aprendidas.
A turma será dividida em grupos de 4 a 5 alunos e orientados na construção do Folder:
1) Os alunos deverão escrever um texto resumindo as ideias principais sobre o assunto, orientando-se pelos artigos, vídeos e animações da seção "Recursos".
2) O professor ajudará na revisão do texto, fazendo a leitura e discutindo as correções no momento em que o grupo estiver fazendo a revisão. Deve-se priorizar a forma do texto, isto é, se está cumprindo sua função de informar brevemente o assunto e ensinar como o alumínio é reciclado.
4) O professor irá recolher os textos a fim de realizar uma revisão mais detalhada, observando a ortografia e aspectos gramaticais.
5) O professor retornará com os textos em sala, irá ler para a turma apontando os erros mais comuns da turma e discutindo com os grupos.
6) Cada grupo deve preparar desenhos que ilustrem o texto elaborado.
7) Confeccionar cartazes apresentando os resultados das pesquisas realizadas em forma de gráficos (colunas, linhas ou pizza).
8) Produzir um vídeo documentário com argumentos sobre os prejuízos causados ao Meio Ambiente e a Sociedade de forma geral, pela não reciclagem do alumínio, que será apresentado para a comunidade escolar.
9) Encontro com a Direção da escola: Os alunos irão se reunir para uma conversa com a Direção da escola. Os alunos irão apresentar o que já estudaram e a importância do engajamento da comunidade escolar em iniciativas de proteção ao meio ambiente, com o objetivo de implantar uma campanha de coleta seletiva na escola.

3ª Tarefa:
A partir do que foi exposto nos artigos, vídeos e animações da seção recursos, responda:
a) Quais as vantagens da reciclagem do alumínio, além da economia na extração de matéria-prima?
b) Discuta com seu grupo por que a reciclagem do alumínio não é obrigatória por lei no Brasil como ocorre no Japão e nos Estados Unidos.
c) Por que nos países em que a reciclagem é obrigatória o índice de alumínio reciclado não chega a 100 %?
d) A reciclagem de latinhas de alumínio foi muito favorecida por questões sociais no Brasil. Explique por quê.
Obs.: As pesquisas podem ser feitas individualmente e as respostas podem ser formuladas pelos grupos. Depois os grupos podem discutir suas conclusões entre si.
e) O alumínio não é um elemento essencial ao organismo humano. Ao contrário, é tido como altamente tóxico. Os sintomas associados à presença de alumínio no organismo foram, até então, detectados como anemia, distúrbios nos ossos e problemas nas funções cerebrais.
Faça uma entrevista com um profissional da área da saúde e procure identificar quais são os principais metais prejudiciais à saúde humana e porque alguns deles podem ser incorporados em tratamentos médicos (procure identificar as reações de oxirredução presentes).
Obs.: A entrevista pode ser presencial, através de e-mail ou na forma de vídeo conferência (Skype).
4ª Tarefa:
Representação de papéis
A turma será dividida em grupos com 5 alunos formando equipes.
Em cada equipe, os alunos desempenharão os papéis de consumidor, vendedor de material de alumínio, ambientalista e publicitário.
Poderá ter mais de um aluno como consumidor.
Os vendedores tentarão seduzir com argumentos os consumidores para que escolham sua versão do produto. O ambientalista deverá pesquisar alguns dados sobre os produtos e alertar os consumidores quanto à degradação que cada um causa no ambiente. O publicitário poderá ajudar o vendedor de material em alumínio a utilizar de recursos que ajudem o convencimento do público.
Ao fim das explanações, os consumidores se reúnem e juntos decidem se vão ou não adquirir os produtos.
Esta decisão deve-se basear na capacidade de argumentação dos alunos.
5ª Tarefa
Porque razão a Prata escurece?
Algumas pessoas ao utilizarem adornos, bijuterias, pulseiras, colar, tornozeleira, etc. confeccionados com a prata, percebem que as vezes os objetos escurecem. A questão é: Por que razão a prata escurece? Vocês já observaram tais reações? O que será que provoca esta reação? Vamos investigar este fenômeno desenvolvendo um experimento.

Experimento Prático
Materiais
Tragam algumas peças de metais ou mesmo pedaços de prata, para serem trabalhadas na sala de aula. Os alunos devem se organizar em dois grupos, de forma que cada equipe tenha metais como o cobre, aço inoxidável, alumínio, prata, estanho, magnésio, manganês, ferro, níquel, etc. disponíveis para manuseio. Será necessário também que tenham reagentes químicos ou naturais como: solução de vinagre contendo cloreto de sódio, permanganato de potássio dissolvido em água, solução de repolho roxo contendo álcool.
Procedimentos
Os grupos devem dividir os metais disponíveis de forma que cada grupo fique com metais de tipos diferentes.
Grupo A: alumínio, prata e estanho, por exemplo.
Deixe o alumínio em contato com a solução de vinagre contendo cloreto de sódio.
Coloque a prata em contato com o permanganato de potássio dissolvido em água.
Junte o estanho à solução de repolho roxo contendo álcool.
Após cerca de 20 minutos verifiquem se ocorreu alguma reação e façam anotações.
Observem e anotem que tipo de reação ocorre.
Grupo B: ferro, aço inoxidável e níquel, por exemplo.
Deixe o alumínio em contato com o ferro e adicione a solução de vinagre contendo cloreto de sódio.
Junte o aço inoxidável e adicione permanganato de potássio dissolvido em água.
Coloque o níquel em contato com a solução de repolho roxo contendo álcool.
Após cerca de 20 minutos verifiquem se ocorreu alguma reação e façam anotações.
Observem e anotem que tipo de reação ocorre.
Em seguida, acessem link:
https://portaldoprofessor.mec.gov.br/storage/recursos/12259/Web/labvirtq/simulacoes/tempUpLoad/sim_qui_limpandoprata.htm, e acompanhem a atividade investigativa proposta.
Depois desse primeiro contato, elaborem um relatório com suas conclusões, para ser enviado para o e-mail do professor.
.jpg)
6ª Tarefa
Reação entre Alumínio e Cobre
Formem grupos de até 5 integrantes e realizem a atividade experimental abaixo no Laboratório de Ciências da escola.
Materiais:
- 1 lata de refrigerante
- Lixa
- Cloreto de sódio (sal de cozinha)
- Solução de sulfato de cobre (o sulfato de cobre pode ser adquirido em casa de produtos para piscina)
Procedimento
Corte a parte superior da lata e logo depois lixe uma parte do interior da lata para retirar a película de plástico existente dentro dela.
Prepare uma solução diluindo 25g de sulfato de cobre em 100 mL de água. Transfira essa solução para dentro da lata até acima da parte lixada. Adicione um pouco de cloreto de sódio na solução de sulfato de cobre, e observe o que acontece.
Discuta com seus colegas de grupo as evidências experimentais que vocês observaram e tente formular uma explicação para o fenômeno observado. Em seguida, escreva um relatório com as conclusões a que o seu grupo chegou e envie para o e-mail do professor.


7ª Tarefa
Eletrólise e banho de metais
Este experimento deve ser realizado em grupo, na residência dos alunos.
Materiais necessários:
- Bateria de 9 V
- Béquer ou qualquer recipiente de vidro transparente
- Pedaços de cobre ou zinco (se houver dificuldade de encontrar cobre, pode-se obtê-lo em fios de cobre, retirando-se o plástico que o envolve; o zinco é utilizado para a cobertura de algumas construções)
- Sulfato de cobre
- Sulfato de zinco
- Fios de cobre (os fios devem ser finos e o ideal é conectar jacarés - presilhas de metal – para facilitar a montagem)
- Peças metálicas, como argolas, clipes etc.
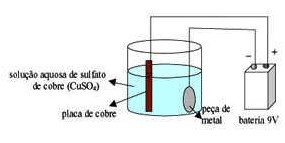
Para dar o banho de cobre, é necessário dissolver sulfato de cobre em água no recipiente de vidro.
Agora responda:
- Quais são os íons que estão presentes na solução?
- Caso queiramos melhorar a eficiência do processo, o que poderíamos fazer?
- O que aconteceu com a peça metálica que mudou de cor?
- Que equação explicaria esse processo?
- Para que serve a placa de cobre conectada ao polo positivo?
Para avaliar se o grupo entendeu bem o processo, façam agora, um banho de zinco em uma peça de cobre. Esse processo, quando realizado em peças de aço, é chamado de galvanização, e serve para que o zinco proteja o aço da ferrugem. Atualmente, esse processo tem uma grande importância industrial, principalmente para melhorar a proteção anticorrosiva de peças metálicas, como geladeiras e carroceria de carros. Façam as conexões tentando inferir, por exemplo, em que polo vocês deverão conectar a peça a ser zincada.
Em seguida, cada grupo deverá elaborar uma apresentação em slides com o relatório da atividade experimental, na qual conste um esquema da aparelhagem montada e as equações da eletrólise desenvolvida. Além disso, procurem também discutir outras possíveis aplicações desse processo. Será realizado na sala de aula um seminário no qual cada grupo irá explicitar as conclusões a que o grupo chegou para o restante dos colegas e para o professor.
.jpg)

8ª Tarefa
Acesse o site abaixo e teste seus conhecimentos sobre Reciclagem: